
Informacion
TEMAS
Mundo de la Quimica

Normas para reducir Riesgos quimicos
•Mantener la cantidad almacenada al mínimo operativo.
•Considerar las características de peligrosidad de los productos y sus incompatibilidades.
•Agrupar los de características similares.
•Separar los incompatibles.
•Aislar o confinar los de características especiales.
•Comprobar etiquetados.
•Llevar un registro actualizado de productos almacenados.
•Emplear armarios de seguridad.
Quimica general

-
Quimica Inorganica
-
Quimica Organica( la quimica del carbon).
-
Quimica Ambiental
Bueno hay varias clases de quimica para el concepto humano. las clases de quimica que tenemos se dividen en:
¿Que es energia o cuerpo?
Energia: Es la capacidad para hacer o realizar un trabajo.
Cuerpo: Bueno cuerpo se refiere a la porcion limitada de la materia con forma determinada.
Tipo de Energias
Energia mecanica: Se encuentra en los elementos y es todo lo que tenga una sustancia quimica
Energia electrica: Son todos los electrodomesticos que nosotros mismo utilizamos en la vida diaria.
Energia Nuclear: Es una energia poco utilizada en nosotros mismos.
Energia Luminosa: son dos tipos:
Fusion: Union de sustancias
Fision: Separacion de sustancias
Energia Hidraulica: Se denomina energía hidráulica, energía hídrica o hidroenergía a aquella que se obtiene del aprovechamiento de las energías cinética y potencial de la corriente del agua, saltos de agua o mareas. Es un tipo de energía verde cuando su impacto ambiental es mínimo y usa la fuerza hídrica sin represarla; en caso contrario, es considerada solo una forma de energía renovable.
Energia Electroestatica: Se produce del imán
Energia eolica: Se produce del viento.
Energia Calorifica o termica: Esta energia se manifiesta en forma del calor.
La materia se la clasifica en:
Mezclas sustancia puras
Heterogenas
Homogeneas
Se forma con una sola sustancia
Elementos simples.-formado porun solo elemento y tmabien como simbolos.
Elementos Compuestos.- Union de dos o mas elementos metales o no metales.
Propiedades de la quimica
Organolécticas
las organolécticas utilizan los sentidos para poder identificarlas sin ningun problemas lo que encontramos en una propiedad organoléctica es:
-
Color= vista
-
Olor= Olfato
-
Sabor= Gusto
-
Impresion= Tacto
-
Sonido= Oido
Sus Cambios: Altera composición quimica de la materia.
Propiedad Intensiva
Esta propiedad no depende de la cantidad de la materia puede ser color, dureza ,densidad, punto de impresión.
Propiedad Extensiva
Esta propiedad depende de la cantidad de la materia volumen, peso y longitud en la que se puede presentar.
Existen:
Inercia:Esta propiedad se puede mantener en su mismo estado.
Impenetrabilidad: Esta propiedad se refiere a que un objeto no puedo ocupar el espacio de otro objeto.
Discontinuidad: Es la que nos indica una materia, objeto o sustancia que pierde sus propiedadades.
Elasticidad: se refiere a que dos cuerpos pueden cambiar su forma cuando se les aplica una cierta cantidad de fuerza, cuando se la deja de utilizar vuelve a su misma propiedad.
Indestrubilidad: Es la que se aplica en todos los cuerpos y son indestructibles.
Densidad: Es la propiedad que tiene como sustancia en el que se calcula la masa y la cantidad de la sustancia.
Dureza: Es la propiedad particular de los solidos es la resistencia de la deformacion.
Visibilidad: Es la propiedad que tiene cualquier cuerpo para poder dividirse en pedazos mas hasta llegar a su estructura minima.
Masa: Es la cantidad contenidad en un volumen cualquiera.
Peso: Es la accion de la gravedad de la tierra sobre los cuerpos.
Propiedad de maliabilidad : Esta propiedad es la capacidad de poder convertir un objeto.
Propiedad de ductividad: Esta propiedad tiene la facilidad que tienen los objetos para poder trasformarse en hilo.
Porpiedad de viscocidad: Es esta Propiedad tienen la capacidad que tienen los liquidos y es la resistencia que tienen los fluidos ante la deformacion.

Cambios de Estado.
Cambios Fisicos de la materia.
-
No vacía la composición quimica de la materia
-
Lo Que se tiene al proncipio se obtiene al final
-
No se forman nuevas sustancias.
Cohesion
Moleculas
Repulsion o dispersion
Cuando poseen de un estado a otro realmente sus moleculas se van dispersando hasta poder alcanzar el miosmo.

De sólido a líquido o viceversa
El proceso mediante el cual al calentar un sólido pasa al estado líquido se denomina fusión. La temperatura a la que tiene lugar el proceso se denomina temperatura de fusión. El proceso inverso se llama solidificación. La temperatura de los puntos de fusión y de solidificación de una sustancia es la misma.
De líquido a gas o viceversa
El proceso por el que un líquido pasa a gas se llama vaporización y se puede producir mediante dos mecanismos distintos: ebullición y evaporación. La evaporación es el paso de líquido a gas a cualquier temperatura. El cambio de estado se produce solo en la superficie. La ebullición es el paso de líquido a gas cuando se alcanza una determinada temperatura, denominada temperatura o punto de ebullición. El cambio de estado se produce en todo el volumen del líquido. El paso de gas a líquido se denomina condensación.
De sólido a gas y viceversa
El paso directo de sólido a gas se llama sublimación. Es un cambio de estado poco frecuente en la naturaleza. El proceso inverso, de gas a sólido, se denomina también sublimación inversa o regresiva.

Unidades de Medidas del sistema internacional.

Densidad de un Material.
Las diferentes partículas que existen en la naturaleza están conformadas por partículas (átomos, iones o moléculas) que según las condiciones de presión y temperatura a las que se encuentran definirán el estado de la materia (sólido, liquido o gaseoso) y una condición muy característica.
Para caracterizar el estado tan singular de la sustancia, se emplea la propiedad física intensiva denominada densidad (ρ), que nos indicara la cantidad de masa del cuerpo material contenido en un volumen definido de ella.
Por lo tanto la masa y el volumen de una sustancia la podemos evaluar así:
masa: m = ρ . V
Volumen: V = m / ρ
Unidades: Las unidades en la que puede estar la densidad son:


Calcular la densidad de un material.
¿Cuál es la densidad de un material, si 30 cm cúbicos tiene una masa de 600 gr?
Solución: Sabemos que
De los datos del problema sabemos que:
m = 600 gr.
V = 30 cm3
Entonces reemplazando en la formula:
ρ = m / V
ρ = 600 gr / 30 cm3
ρ = 20 gr / cm3
•Ep = m. g.h
•La energía potencial es igual a la masa del cuerpo multiplicada por la gravedad y por la altura a la que se encuentra desde un centro de referencia.
•La gravedad es una constante de 9,8 m/s2
•Ec = ½.m.v2
•La energía cinética es igual a un medio del producto entre la masa y el cuadrado de la velocidad.
•Em = Ep + Ec
•La energía mecánica es la suma entre la energía potencial y cinética.
Unidades de medida de Temperatura.
La temperatura es una magnitud física que refleja la cantidad de calor, ya sea de un cuerpo, de un objeto o del ambiente. Dicha magnitud está vinculada a la noción de frío (menor temperatura) y caliente (mayor temperatura).
Escalas de Temperatura.
•Escalas Relativas: Consideran como referencia el punto de ebullición y solidificación de una sustancia o mezcla.
Escala Celsius o Centígrado: Toma como compuesto de referencia el agua: punto de ebullición 100 ° C y punto de solidificación 0 °C. El nombre se debe al físico Andrés Celsius que la propuso en 1742
Escala Fahrenheit: Toma como referencia el punto de congelamiento de una solución amoniacal 0 °F. La temperatura de congelación del agua es de 32° F y la de ebullición es de 212 °F.
•Escalas absolutas: Son las que consideran al cero absoluto como punto de referencia, en el cero absoluto se considera que no existe movimiento molecular
Escala Kelvin: El punto de congelamiento del agua es 273 K y el de ebullición 373 K. Llamada así en honor a su creador, el físico inglés William Kelvin. No lleva el símbolo de grados °
Escala Rankine: El punto de congelamiento del agua es 492 ° R
Fórmulas:
°C = 5(°F-32)/9
°F = 9 °C/5 + 32
K = °C + 273
R = °F + 459,67

Relacion de escalas
EL ATOMO

El átomo es un constituyente de la materia ordinaria, con propiedades químicas bien definidas, formado a su vez por constituyentes más elementales sin propiedades químicas bien definidas. Cada elemento químico está formado por átomos del mismo tipo (con la misma estructura electrónica básica), y que no es posible dividir mediante procesos químicos.
Actualmente se conoce que el átomo está compuesto por un núcleo atómico, en el que se concentra casi toda su masa, rodeado de una nube de electrones. Esto fue descubierto a principios del siglo XX, ya que durante el siglo XIX se había pensado que los átomos eran indivisibles, de ahí su nombre a-tómo- 'sin división'.
Poco después se descubrió que también el núcleo está formado por partes, como los protones, con carga positiva, y neutrones, eléctricamente neutros.Los electrones, cargados negativamente, permanecen ligados a este mediante la fuerza electromagnética.
Los átomos se clasifican de acuerdo al número de protones y neutrones que contenga su núcleo. El número de protones o número atómico determina su elemento químico, y el número de neutrones determina su isótopo. Un átomo con el mismo número de protones que de electrones es eléctricamente neutro.
Si por el contrario posee un exceso de protones o de electrones, su carga neta es positiva o negativa, y se denomina ion.
Modelos Atómicos

Modelo Atómico de Dalton
Modelo Atómico Thomson
Modelo Atómico de Rutherford
Modelo Atómico de bohr
Modelo Atómico de Dalton

El modelo atómico de Dalton surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, formulado entre 1803 y 1807 por John Dalton.
El modelo permitió aclarar por primera vez por qué las sustancias químicas reaccionaban en proporciones estequiométricas fijas (Ley de las proporciones constantes), y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros (Ley de las proporciones múltiples). Por ejemplo 12 g de carbono (C), pueden reaccionar con 16 g de oxígeno (O2) para formar monóxido de carbono (CO) o pueden reaccionar con 32 g de oxígeno para formardióxido de carbono (CO2).
•Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos.
•Todos los átomos de un elemento químico dado son idénticos en su masa y demás propiedades.
•Los átomos de diferentes elementos químicos son distintos, en particular sus masas son diferentes.
•Los átomos son indestructibles y retienen su identidad en los cambios químicos.
•Los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí, en una relación de números enteros sencilla, formando entidades definidas (hoy llamadas moléculas).


Modelo Atómico de Thomson

El modelo atómico de Thomson es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, quien descubrió elelectrón1 en 1897, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, embebidos en éste al igual que las pasas de un budín. A partir de esta comparación, fue que el supuesto se denominó "Modelo del budín de pasas".2 3 Postulaba que los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad.
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas: una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella.

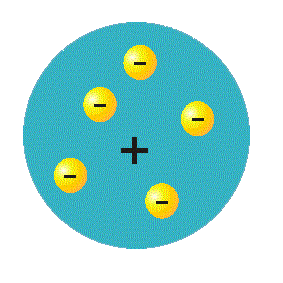
Modelo Atómico de Rutherford

Sir Ernst Rutherford (1871 - 1937), famoso hombre de ciencia inglés que obtuvo el premio Nobel de Química en 1919, fue un físico neozelandés que identificó en 1898 dos tipos de las radiaciones emitidas por el Uranio, a las que llamó alfa y beta.
El hecho de que sólo unas pocas radiaciones sufriesen desviaciones hizo suponer que las cargas positivas que las desviaban estaban concentradas dentro de los átomos ocupando un espacio muy pequeño en comparación a todo el tamaño atómico; esta parte del átomo con electricidad positiva fue llamado NÚCLEO.
En el modelo de Rutherford, los electrones se movían alrededor del núcleo como los planetas alrededor del Sol. La carga eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando que el átomo sea eléctricamente neutro.
Los electrones no caían en el núcleo, ya que la fuerza de atracción electrostática era contrarrestada por la tendencia del electrón a continuar moviéndose en línea recta. Este modelo fue satisfactorio hasta que se observó que estaba en contradicción con una información ya conocida en aquel momento: de acuerdo con las leyes del electromagnetismo, un electrón o todo objeto eléctricamente cargado que es acelerado o cuya dirección lineal es modificada, emite o absorbe radiación electromagnética.

Modelo Atómico de Bhor

Después de los descubrimientos de Rutherford, los científicos pensaron en el átomo como un sistema solar microscópico, con los electrones girando en órbita alrededor del núcleo, Bohr al principio supuso que los electrones se movían en órbitas circulares, pero la física clásica decía que una partícula con carga eléctrica debía perder energía, lo que llevaría en un momento hacer al electrón caer hacia el núcleo, entonces Bohr dijo que las leyes conocidas de la física eran inadecuadas para describir algunos procesos de los átomos. El físico Danés Niels Bohr, premio Nobel de Física en 1922, introdujo en 1913 los tres postulados siguientes:
Primer Postulado: El producto del impulso o cantidad de movimiento (mv) del electrón por la longitud de la órbita que describe es un múltiplo del cuanto de energía (primer postulado).
Segundo Postulado: Mientras un electrón gira en una orbita fija no emite energía radiante.
Tercer Postulado: Un electrón puede saltar desde una orbita de energía a otra inferior de menor energía. En este salto el átomo emite una cantidad de energía radiante igual a la diferencia de energía de los estados inicial y final.

Numeros Cuánticos

Los números cuánticos son unos números asociados a magnitudes físicas conservadas en ciertos sistemas cuánticos. En muchos sistemas el estado del sistema puede ser representado por un conjunto de números, los números cuánticos, que se corresponden con valores posibles de observables que conmutan con el Hamiltoniano del sistema. Los números cuánticos permiten caracterizar los estados estacionarios, es decir los estados propios del sistema.
En física atómica, los números cuánticos son valores numéricos discretos que indican las características de los electrones en los átomos, esto está basado en la teoría atómica de Niels Bohr que es el modelo atómico más aceptado y utilizado en los últimos tiempos por su simplicidad.
En física de partículas, también se emplea el término números cuánticos para designar a los posibles valores de ciertos observables o magnitud física que poseen un espectro o rango posible de valores discretos.
El Atomo y su Estructura

Atomo
El átomo es la menor fracción en que puede dividirse un elemento simple sin que pierda sus propiedades químicas y pudiendo ser objeto de una reacción química. Está formado por un conjunto de nucleones (protones y neutrones), situados en el núcleo, que concentra la casi totalidad de la masa atómica y a cuyo alrededor gira, en distintos orbitales, un número de electrones igual al de protones.
Molécula
Partícula formada por una agrupación ordenada y definida de átomos, que constituye la menor porción de un compuesto químico que puede existir en libertad.
Las moléculas sólo se hallan perfectamente individualizadas en los gases en estado de movimiento rectilíneo desordenado, en cuyo caso su interacción se limita a choques muy breves. En los líquidos, si bien las moléculas se desplazan libremente, existe un mayor contacto intermolecular. En los sólidos, las moléculas ocupan por lo general posiciones fijas en los nudos de redes cristalinas. Los agregados atómicos moleculares pueden ser polares o no polares.
Los Protones
En física, el protón (en griego protón significa primero) es una partícula subatómica con una carga eléctrica de una unidad fundamental positiva. Experimentalmente, se observa el protón como estable, con un límite inferior en su vida media de unos 1035 años, aunque algunas teorías predicen que el protón puede desintegrarse. El protón y el neutrón, en conjunto, se conocen como nucleones, ya que conforman el núcleo de los átomos.
Los protones están clasificados como bariones y se componen de dos quarks arriba y un quark abajo, los cuales también están unidos por la fuerza nuclear fuerte mediada por gluones. El equivalente en antimateria del protón es el antiprotón, el cual tiene la misma magnitud de carga que el protón, pero de signo contrario.
Los Neutrones
Un neutrón es un barión neutro formado por dos quarks down y un quark up. Forma, junto con los protones, los núcleos atómicos. Fuera del núcleo atómico es inestable y tiene una vida media de unos 15 minutos emitiendo un electrón y un antineutrino para convertirse en un protón. Su masa es muy similar a la del protón.
El neutrón es necesario para la estabilidad de casi todos los núcleos atómicos (la única excepción es el hidrógeno), ya que interactúa fuertemente atrayéndose con los protones, pero sin repulsión electrostática.
Los Electrones
El electrón , comúnmente representado como e−) es una partícula subatómica de tipo fermiónico. En un átomo los electrones rodean el núcleo atómico, compuesto fundamentalmente de protones y neutrones.
Los electrones tienen una masa pequeña respecto al protón, y su movimiento genera corriente eléctrica en la mayoría de los metales. Estas partículas desempeñan un papel primordial en la química ya que definen las atracciones con otros átomos.
Configuración Electronica

La configuración electrónica de un átomo es una designación de la distribución de los electrones entre los diferentes orbitales, en las capas principales y las subcapas. La notación de la configuración electrónica utiliza los símbolos de subcapa (s, p, d y f) y cada uno con un superíndice que indica el número de electrones en ese subnivel.
Por ejemplo para el Li el cual tiene 3 electrones sería, 1s2 2s1; el número que se encuentra al lado de la subcapa es n, la letra representa el subnivel y el superíndice el número de electrones en ese subnivel.
Tipos de configuración electrónica
Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor complejidad de comprensión, que son:
Configuración estándar: Se representa la configuración electrónica que se obtiene usando el cuadro de las diagonales. Es importante recordar que los orbitales se van llenando en el orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
Aplicando el mencionado cuadro de las diagonales la configuración electrónica estándar, para cualquier átomo, es la siguiente:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Configuración condensada: Los niveles que aparecen llenos en la configuración estándar se pueden representar con un gas noble (elemento del grupo VIII), donde el número atómico del gas coincida con el número de electrones que llenaron el último nivel. Los gases nobles son He, Ne, Ar, Kr, Xe y Rn.
Configuración desarrollada: Consiste en representar todos los electrones de un átomo empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund.
Configuración semidesarrollada: Esta representación es una combinación entre la configuración condensada y la configuración desarrollada.
Ejercicio
Configuración electrónica del Ra: Z = 88 quiere decir que tiene 88 e-
La configuración electrónica es:
1 s2 2 s2 p6 3 s2 p6 d10 4s2 p6 d10 f14 5s2 p6 d10 6 s2 p6 7 s2
Tabla Periódica

Tabla Periódica de Elementos Químicos. La Tabla Periódica de Elementos Químicos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características. La misma se le atribuye al químico ruso Dimitri Ivanovich Mendeléiev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Jullius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléiev, fue diseñada por Alfred Werner.

CLASIFICACIÓN DE LAVOISIER
El propio Lavoisier dio la primera clasificación de elementos agrupando los mismos en: Metales, no metales y metaloides o metales de transición.

METALES
Propiedades Fisicas
• Brillo: reflejan la luz que incide en su superficie.
• Dureza: la superficie de los metales oponen resistencia e dejarse rayar por objetos agudos.
• Tenacidad: los elementos presentan mayor o menor resistencia a romperse cuando ejercen sobre ellos una presión.
• Ductilidad: los metales son fácilmente estirados en hilos finos (alambres), sin romperse.
• Maleabilidad: ciertos metales, tales como el oro, la plata y el cobre, presentan la propiedad de ser reducidos a delgadas láminas, sin romperse.
• Conductividad Calórica: los metales absorben y conducen la energía calórica.
• Conductividad Eléctrica: los metales permiten el paso de la corriente eléctrica a través de su masa.
• Densidad: la inmensa mayoría de los metales presentan altas densidades.
• Fusibilidad: la inmensa mayoría de los metales presentan elevadísimos puntos de fusión, en mayor o menor medida para ser fundidos..
Propiedades Quimicas
Los metales son muy reactivos, con los no metales, especialmente con los halógenos. Forman óxidos, sales, hidróxidos (bases).
• La formación de óxidos básicos ocurre cuando un metal reacciona con el oxigeno, como en el caso de la formación de herrumbre (oxido de hierro) durante la oxidación lenta del hierro. Ejemplo: hierro + oxigeno à oxido de hierro
• La formación de hidróxido ocurre cuando un metal alcalino reacciona con el agua. Esta reacción es muy violenta para estoy metales, particularmente en el caso del sodio, que forma hidróxido de sodio. Ejemplo: sodio + agua à hidróxido de sodio
• La formación de sales ocurre cuando un metal reacciona con un acido y libera el gas hidrogeno. Los metales alcalinos reaccionan en forma explosiva con los ácidos, por lo que se debe evitar su contacto. Ejemplo: Magnesio + Acido Clorhídrico à cloruro de magnesio + hidrogeno
NO METALES
Propiedades Fisicas
-
Los no metales varían mucho en su apariencia.b. No son lustrosos.c.
-
Por lo general son malos conductores del calor y la electricidad.d.
-
Sus puntos de fusión son más bajos que los de los metales (aunque el diamante, una forma decarbono, se funde a 3570 ºC).
-
A temperatura ambiente los encontramos en estado gaseoso (H2, N2, 02, F2y C12), líquido (Br2) yun sólido volátil (I2). El resto de los no metales son sólidos que pueden ser duros como el diamante oblandos como el azufre.
-
Al contrario de los metales, son muy frágiles y no pueden estirarse en hilos ni en láminas.
-
No tienen brillo metálico y no reflejan la luz.
-
Muchos no metales se encuentran en todos los seres vivos: carbono, hidrógeno, oxígeno, nitrógeno,fósforo y azufre en cantidades importantes. Otros son oligoelementos: flúor, silicio, arsénico, yodo,cloro
ENLACES QUIMICOS
Es la unión entre átomos el cual desprende energía; la distancia a la que se colocan los átomos es a la que se desprende mayor energía produciendo la máxima estabilidad
Enlace Iónico
Los enlaces iónicos ocurren generalmente entre un elemento muy electronegativo, como un no metal con otro elemento poco electronegativo como un metal.
Los no metales, debido a su elevada electronegatividad, al enlazarse iónicamente con los metales, adquieren carga eléctrica negativa.
Átomos con exceso de electrones, o sea, con carga eléctrica negativa son llamados aniones. Ya, los metales, en el enlace iónico, adquieren carga eléctrica positiva debido a la pérdida de uno o más electrones.
Átomos que cedieron electrones, o sea, adquirieron carga eléctrica positiva, son llamados cationes.
Las principales propiedades de los compuestos iónicos son:
-
Altos puntos de fusión y ebullición
-
Conducen corriente eléctrica cuando son disueltos en agua o fundidos
-
Presentan aspecto cristalino
Un ejemplo de compuesto iónico, está, ciertamente en nuestras cocinas. Se trata del cloruro de sodio, popularmente conocido como sal de mesa. Esta sal está compuesta por dos elementos, un metal, el Sodio y un no metal, el Cloro.
Ambos elementos por medio del enlace iónico, adquieren una estabilidad energética, la cual es explicada por la regla del octeto. La regla dice que los átomos con excepción del hidrógeno, adquieren estabilidad al poseer ocho electrones en su última capa.
Enlace Iónico
Se establece entre átomos de elementos metálicos y no metálicos (gran diferencia de electronegatividad). Puede entenderse como consecuencia de la cesión permanente de electrones entre átomos y la consiguiente atracción electrostática derivada de la formación de iones.
Enlace Covalente
Si en los enlaces iónicos existía la donación de electrones, en los enlaces covalentes ocurre el compartimiento de electrones entre los átomos que establecen el enlace. Esto ocurre entre átomos que poseen poca diferencia de electronegatividad. En este tipo de enlaces, hay dos tipos de situaciones.
La primera es cuando los átomos que constituyen el enlace son iguales. En este caso, decimos que el enlace es covalente apolar, o sea, sin polos, pues ambos átomos atraen igualmente los electrones del enlace, no existiendo polaridad.
La segunda es, cuando los átomos que constituyen el enlace son diferentes. En este caso, decimos que ella es covalente polar, o sea, ocurre la formación de polos, pues los átomos debido a la electronegatividad diferente entre ellos, atraen de forma diferente los electrones constituyentes del enlace.
Se forman moléculas pequeñas casi independientes unas de otras. Estos compuestos no son muy duros, tienen bajos puntos de fusión y de ebullición, sin conducir corriente eléctrica y tienden a ser insolubles en agua. Su estado físico es variado (gases, a veces líquidos y sólidos). Otro tipo de compuestos covalentes son los sólidos reticulares.
Las principales propiedades de los compuestos covalentes son:
-
Pueden existir, en condiciones ambiente, en los estados gaseoso, líquido y sólido. Cuando se presentan en estado sólido, poseen puntos de fusión y ebullición más bajos, comparados con los de las sustancias iónicas o metálicas.
-
Algunas son solubles en agua, otras son solubles en solventes orgánicos y otros aún, son solubles en ambas.
-
Normalmente, no son conductoras de electricidad, ni siquiera puros, ni aún disueltos en agua. La excepción a esta regla ocurre en el caso de los ácidos, que cuando están en solución, conducen la corriente eléctrica.
Un ejemplo de compuesto covalente apolar es el oxígeno, presente en el aire que respiramos, disuelto en el agua de los ríos y mares en los cuales los peces respirar y en el proceso de combustión de la parafina de una vela.
Un ejemplo de compuesto covalente polar es el monóxido de dihidrógeno, conocido popularmente como agua. Considerada un solvente universal, el agua corresponde al 70% en masa de nuestro cuerpo. Ella debería ser un gas, pero debido a la fuerte interacción entre sus moléculas, conocida por “enlace de hidrógeno”, en temperatura y presión ambientes, su estado físico es líquido.
Enlace Metálico
Los metales de un modo general son poco electronegativos, no ejerciendo por tanto, una atracción muy fuerte sobre los electrones de la última capa. Debido a esta característica, el enlace metálico se constituye por la configuración de retículos cristalinos, perfectamente definidos, formados por cationes de carga eléctrica positiva que son neutralizados por electrones, los cuales, en este caso, estarán presos a los átomos más libres, lo que explica gran parte de las propiedades de los metales.
Principales propiedades de los compuestos metálicos:
-
Buenos conductores de calor y electricidad
-
La mayoría se presenta en estado sólido
-
La mayoría posee puntos de fusión y ebullición elevados
-
Son maleables o dúctiles
-
Poseen brillo característico
Un ejemplo de compuesto metálico, puede ser el oro, que es un metal noble, muy valorizado en el mercado. El es generalmente comercializado en la forma de mezcla con otros compuestos, mezcla que, en los metales tiene el nombre de aleación.
El oro 18 kilates por ejemplo, es una aleación de 18 partes de oro y 6 partes de otros metales, representando así 75% de oro y 25% de plata, cobre o bronce. La utilización de la aleación del oro con otros metales, se debe al hecho de que el oro puro (24 kilates) es demasiado blando y eso lo hace inadecuado para la producción de una joya cualquiera.






























